Einführung in die Verbrennung - Vorlesung
07 May 2025, Andreas Huber, Torsten Methling, Holger Huck, Nils Jakobs
Thermodynamik
Grundlagen Thermodynamik
Wiederholungen:
- 1.-/2. Hauptsatz, Innere Energie, Enthalpie, Wärmekapazität
- Thermodynamisches System:
- Eine Region im Raum - Bilanzraum - die von der Umgebung durch Begrenzungsflächen - Systemgrenzen - abgegrenzt wird
- Die Systemgrenzen sind frei wählbar, unterscheidbar aufgrund
- Lage (ortsfest / beweglich)
- Durchlässigkeit (Masse / Energie)
- Einteilung des Systems in
- Offenes System: durchlässig für Masse und Energie
- Geschlossenes System: kein Massenaustausch, durchlässig für Energie
- Abgeschlossene System: kein Austausch von Energie und Masse
- System wird durch Zustandsgrößen charakterisiert
- Zusammenhänge zwischen Zustandsgrößen: Zustandsfunktionen
- isotherm (Temperatur konstant)
- isobar (Druck konstant)
- isochor (Volumen konstant)
- adiabat (kein Wärmefluss)
- Zustandsänderungen umkehrbar: reversibel (eher theoretisch)
- Zustandsänderungen nicht umkehrbar: nicht reversibel
Ideales Gasgesetz
$$p V = n R_m T$$
$$p V = m R T$$
$$p = \rho R T$$
1. Hauptsatz der Thermodynamik
Jedes thermodynamische System besitzt eine Zustandsgröße Energie, die für ein abgeschlossenes System konstant ist
Energie kann weder erzeugt noch vernichtet werden, sie kann sich umwandeln oder austauschen
Wärmekapazität
beschreibt Temperaturänderung eines Systems bei Zuführung einer Wärmemenge $\delta Q = CdT$
- Bei konstantem Volumen: $dU = \delta Q = C_v D T$
- Bei konstantem Druck: $dH = \delta Q = C_p D T$
Kalorische Zustandgleichung
- Spezifische Wärmekapazitäten sind temperaturabhängig
- Verbrennung:
- Große T-Änderung
- Thermisch perfekt (nur T-abhängig)
- Anwendung
- Tabelliert als Funktion der Temperatur
- Polynomfit
Heizwert
- Wärmemenge, die bei Standardbedingungen frei wird $\rightarrow$ Reaktionsprodukt Wasser (gasförmig)
- Umgekehrtes Vorzeichen zur Reaktionsenthalpie: Reaktionen mit Wärmefreisetzung haben negative Reaktionsenthalpie
Brennwert
- Wärmemenge, die bei Standardbedingungen frei wird $\rightarrow$ Reaktionsprodukt Wasser (flüssig)
- Um die Verdampfungsenthalpie von Wasser größer als der Heißwert: Brennwert = Heizwert + Kondensationswärme
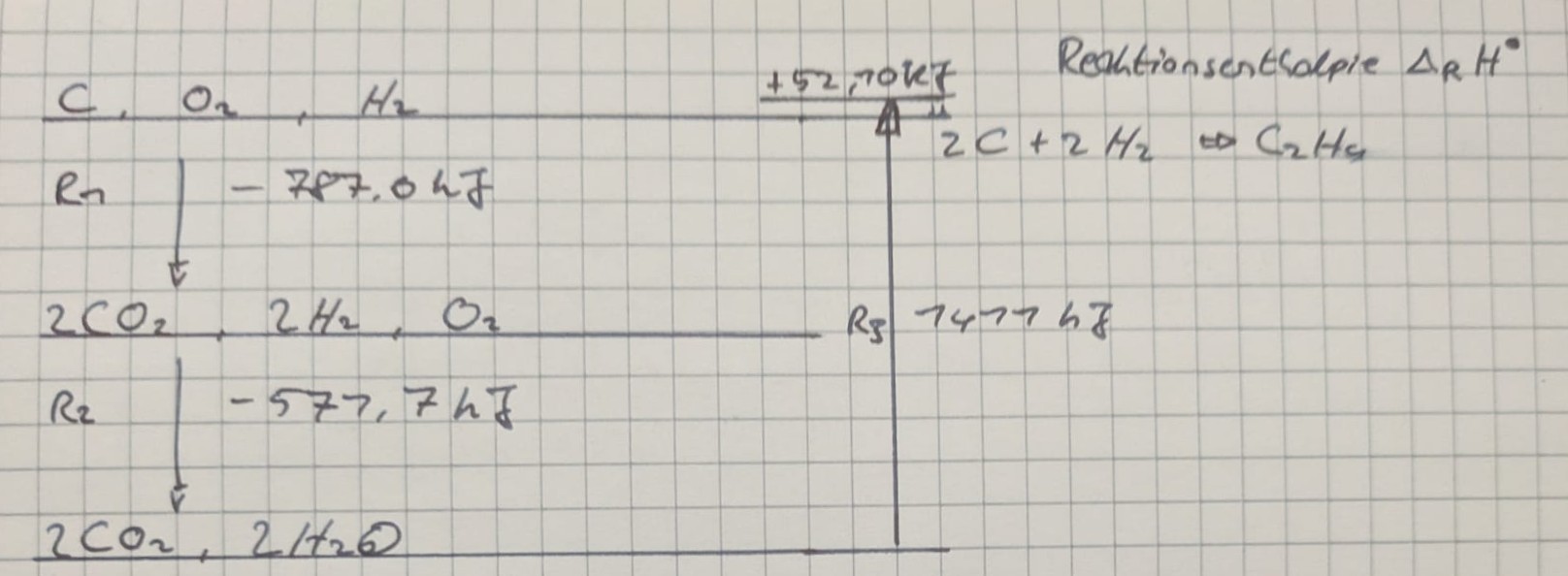
Satz von Hess
Die Standartreaktionsenthalpie einer Rekation ist gleich der Summe der Standardbildungsenthalpien einer Reaktionsfolge, in die die gesuchte Reaktion formal zerlegt werden kann.
Adiabatische Flammentemperatur
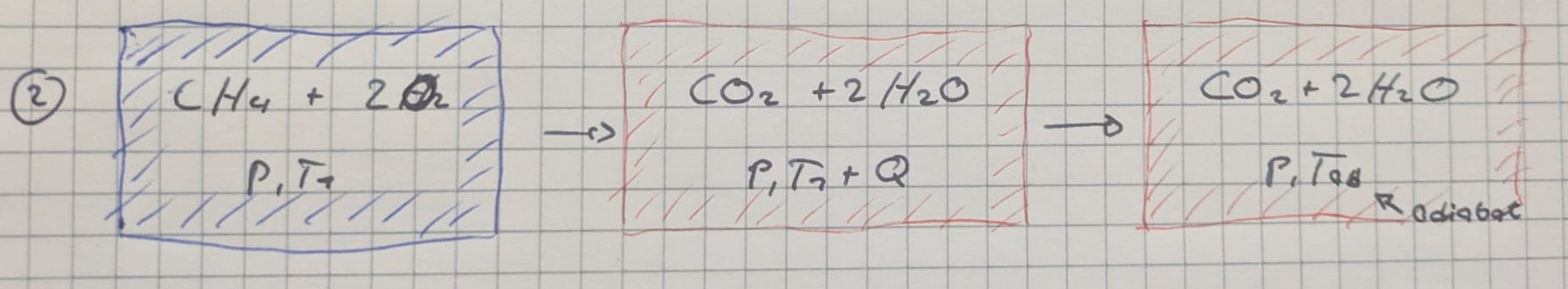
- Enthalpieänderung bei Reaktion: $dH = dU + p d V + V d p = \delta Q - V d p$
- d: Änderung der Zustandsgröße - wegunabhängig
- $\delta$: Änderung der Prozessgröße - wegabhängig
- Näherungen für praktische Anwendungen
- Reaktion läuft vollständig ab
- Nur wenige stabile Reaktionsprodukte
- typisch: Nur CO$_2$, H$_2$O
- Keine Dissoziation der Verbrennungsprodukte
- Abschätzung der maximalen Temperatur
Berechnung über Ansatz Enthalpieerhaltung: Enthalpie-Differenz von Produkten (reagierter Zustand 2 und @ adiabater Flammentemp. $T_{ad}$) und Edukten (Zustand 1 und @ Ausgangstemp. $T_1$)
2. Hauptsatz der Thermodynamil
Jedes thermodynamische System besitzt eine Zustandsgröße Entropie $S$. Entropie kann im Inneren eines Systems nur erzeugt, nie aber vernichtet werden
- Reversible Zustandsänderungen: Entropieänderung wird berechnet, indem man die mit der Umgebung reversibel ausgetauschte Wärme $Q_{rev}$ durch die absolute Temperratur $T$ an der Stelle des Wärmetauschers teilt
Zahlreiche physikalisch-chemische Prozesse verletzen nicht den 1. Hauptsatz (Energieerhaltung), finden aber trotzdem nie statt
- Bsp. zwei Körper um thermischen Kontakt nehmen gemeinsame Temperatur an
- nicht: 1 Körper erwärmt sich, 1 Körper kühlt ab
- Folgerung: Aussagen über Richtung von thermodynamischen Prozessen werden gebraucht
- Zustandsänderung:
- Reversible Zustandsänderung
- Irreversible Zustandsänderung
Thermodynamisches Gleichgewicht
- Mechanisches Gleichgewicht
- Temperatur in A und B gleich ($T_A = T_B = T_{AB}$)
- Es findet Druckausgleich statt
- Es gilt die Ideale Gasgleichung und Gesamtdruck = Summe der Partialdrücke
- Thermisches Gleichgewicht
- Summe der inneren Energien ist Konstant $dU = 0$
- Ideale Gasgleichung
- Chemisches Gleichgewicht (neu in dieser Vorlesung)
- Es findet Reaktionen statt, bis makroskopisch kein Umsatz mehr zu beobachten ist $\rightarrow$ chemisches Gleichgewicht
- Zusätzlich auch mechanisches und thermosches Gleichgewicht $\rightarrow$ thermodynamisches Gleichgewicht
Berechnung
Verschiedene Gleichgewichtskonstanten $K_{\text{"index"}}$:
Jede Gleichgewichtskonstante gehört zu einer Reaktion
- $K_p$ ... Verhältnis der Partialdrücke $p$ (normiert mit Standarddruck $p_0$)
- $K_x$ ... Verhältnis der Molenbrüche $x$
- $K_c$ ... Verhältnis der Konzentrationen $c$
Gleichgewichtskonstanten können ineinander umgerechnet werden
Prinzib des kleinsten Zwangs
Wird auf ein im Gleichgewichtszustand befindliches System durch Änderungen der äußeren Bedingungen ein Zwang ausgeübt, so verschiebt sich die Lage des Gleichgewichts so, dass die Wirkung der Änderung verkleinert wird.
Fragen
Der zweite Hauptsatz der Thermodynamik beschreibt vereinfacht ausgedrückt...
...die Prozessrichtungen thermodynamischer Prozesse
Ordnen Sie den Zustandsgrößen-Änderungen eine der Bezeichnungen isobar, isentrop, isotherm oder isochor zu:
Entropie $S$ = const. isentrop
Volumen $V$ = const. isochor
Druck $p$ = const. isobar
Temperatur $T$ = const isotherm